根據(jù)美國食品和藥物管理局(FDA)公布的數(shù)據(jù)嬉荆,2024年上半年浸须,美國FDA共拒絕11023批外國產(chǎn)品進(jìn)入市場移怯,其中中國被拒2631批,較去年同期增長 213.59%和橙。
中國產(chǎn)品被美國FDA拒絕進(jìn)口數(shù)量激增仔燕,主要是由于醫(yī)療和煙草類產(chǎn)品被拒批次顯著增加造垛。
2024年上半年,我國被美國FDA拒絕進(jìn)口的醫(yī)療器械和藥品共計1651批晰搀,占全球同類產(chǎn)品受阻 FDA 總數(shù)的33.26%五辽,較去年同期增加 21.86%。
從受阻地區(qū)分布看外恕,上海杆逗、江蘇產(chǎn)品較多,從全國范圍看鳞疲,我國被美國FDA 拒絕進(jìn)口的醫(yī)療器械和藥品主要分布在:上海(782批次)罪郊,江蘇(363批次)、廣東(123批次)建丧、山東(108批次)排龄、河北(106批次)、浙江(73批次)翎朱、天津(33批次)、江西(23批次)等地尺铣。詳見圖1拴曲。
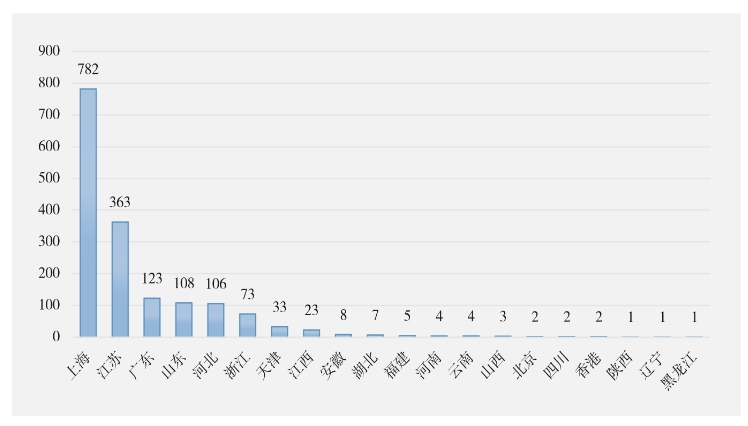
圖1 2024 年上半年中國出口醫(yī)療器械和藥品被美國FDA 拒絕進(jìn)口地區(qū)分布情況(單位:批次)
上半年,上海在全國范圍內(nèi)因FDA監(jiān)管而遇到的醫(yī)療器械和藥品出口受阻情況最為嚴(yán)重凛忿,占全國同類受阻產(chǎn)品總量的47.37%澈灼。上海受阻的782批次產(chǎn)品中,活塞式注射器占絕大多數(shù)店溢,比例高達(dá)94.76%叁熔。江蘇為上半年出口受阻情況第二嚴(yán)重的省市,363批次受阻產(chǎn)品中同樣以活塞式注射器為主床牧,占比達(dá)89.81%荣回。上述數(shù)據(jù)突顯了在醫(yī)療器械領(lǐng)域,活塞式注射器類產(chǎn)品出口美國的過程中面臨著嚴(yán)峻的監(jiān)管挑戰(zhàn)和審查壓力戈咳。
一心软、從受阻產(chǎn)品看,醫(yī)療設(shè)備被拒絕進(jìn)口最多
美國FDA 拒絕進(jìn)口的醫(yī)療器械和藥品主要包括醫(yī)療設(shè)備著蛙、醫(yī)藥與生物制品删铃、激光類產(chǎn)品三大類。
2024年上半年踏堡,我國遭拒的醫(yī)療設(shè)備為1557批猎唁,占我國醫(yī)療類產(chǎn)品受阻總數(shù)的94.31%,受阻產(chǎn)品主要為活塞式注射器顷蟆、潤滑劑诫隅、真空采血管等缎患。遭拒的醫(yī)藥與生物制品73批,占我國醫(yī)療類產(chǎn)品受阻總數(shù)的 4.42%阎肝,受阻產(chǎn)品主要為吡喹酮(抗寄生蟲藥)挤渔、肉毒桿菌、異丙醇(外用抗肝炎藥)等风题。遭拒的激光類產(chǎn)品21批判导,占我國受阻產(chǎn)品總數(shù)的1.27%,受阻產(chǎn)品主要為光纖激光器激光雕刻機(jī)沛硅、激光瞄準(zhǔn)器等眼刃。值得關(guān)注的是,美國FDA對中國制造的活塞式注射器加強(qiáng)了監(jiān)管摇肌,導(dǎo)致相關(guān)產(chǎn)品被拒絕進(jìn)口數(shù)量顯著增加擂红。
2024年上半年,活塞式注射器共被拒絕進(jìn)11078批次围小,生產(chǎn)廠商主要集中在上海昵骤、江蘇、浙江和廣東肯适。FDA還向美國注射器供應(yīng)商变秦、消費者、醫(yī)療保健提供者和醫(yī)療機(jī)構(gòu)提出建議框舔,建議用戶立即停止使用這些制造商生產(chǎn)的活塞式注射器蹦玫,除非在完成向非中國制造注射器過渡之前必須使用這些注射器。
二刘绣、從受阻原因看涉及未注冊樱溉、質(zhì)量或標(biāo)簽不符合要求等
1、機(jī)構(gòu)未按照美國《聯(lián)邦食品纬凤、藥品和化妝品法案》(FD&CAct)第510條的規(guī)定在FDA正式注冊福贞。
案例:
2024年6月27日美國FDA通報拒絕進(jìn)口的太陽鏡;2024年5月21日美國FDA通報拒絕進(jìn)口的骨內(nèi)植入物移斩;2024年4月17日美國FDA通報拒絕進(jìn)口的多西環(huán)素(四環(huán)素類)肚医,均因未按照美國《聯(lián)邦食品、藥品和化妝品法案》第510條的規(guī)定在 FDA 正式注冊而被拒絕進(jìn)口向瓷。
法規(guī)解析:
根據(jù)《聯(lián)邦食品肠套、藥品和化妝品法案》第510條,所有在美國境內(nèi)從事生產(chǎn)猖任,制備你稚、傳播、合成或加工醫(yī)療器械的機(jī)構(gòu),都必須遵守特定的注冊和上市前通知【premarket notifcation刁赖,即510(k)〕要求搁痛。如果該機(jī)構(gòu)未在FDA 正式注冊,則被拒絕進(jìn)口宇弛。
2鸡典、產(chǎn)品不在 510(j)的清單內(nèi)或未按照 510(j)/510(k)的要求提供所需信息。
案例:
2024年6月7日美國FDA通報拒絕進(jìn)口的膽道導(dǎo)管枪芒;2024年5月29日美國FDA通報拒絕進(jìn)口的注射器彻况;2024年4月29日美國FDA通報拒絕進(jìn)口的眼科用鉗,均因產(chǎn)品未在510(j)的清單內(nèi)或未按照510(j)/510(k)的要求提供所需信息而被拒絕進(jìn)口舅踪。
法規(guī)解析:
根據(jù)《聯(lián)邦食品纽甘、藥品和化妝品法案》規(guī)定,如果產(chǎn)品不在510(j)清單內(nèi)抽碌,或者制造商未按照510(j)/510(k)的要求提供所需信息(包括但不限于產(chǎn)品設(shè)計悍赢、性能測試結(jié)果、生物相容性評估货徙、滅菌工藝左权、產(chǎn)品有效期、臨床數(shù)據(jù)等)破婆,以證明該產(chǎn)品與已合法上市的器械同樣安全有效(即等價器械)涮总,則被視為不符合上市要求而被拒絕進(jìn)口。
3祷舀、初始分銷商未按照21CFR 807.20(a)(5)的要求注冊,且產(chǎn)品受510(j)項的清單要求限制烹笔。
案例:
2024年6月7日美國FDA通報拒絕進(jìn)口的輸尿管結(jié)石移除器裳扯,2024年4月16日美國 FDA 通報拒絕進(jìn)口的血液血漿加熱器,2024年2月8日美國FDA通報拒絕進(jìn)口的鹽酸克林霉素棕櫚酸醋(林可霉素類)谤职,均因初始分銷商未按照 21 CFR 807.20(a)(5)的要求注冊饰豺,且產(chǎn)品受510(j)項的清單要求限制而被拒絕進(jìn)口。
法規(guī)解析:
根據(jù)《聯(lián)邦食品允蜈、藥品和化妝品法案》第801(a)(3)條規(guī)定冤吨,如果初始分銷商沒有按照21CFR807.20(a)(5)的要求注冊,且初始分銷商未根據(jù)法案第510條要求列出其商業(yè)分銷的設(shè)備清單饶套,則被拒絕進(jìn)口漩蟆。
4、產(chǎn)品質(zhì)量不符合 FDA 的標(biāo)準(zhǔn)或要求妓蛮。
案例:
2024年4月4日美國FDA通報拒絕進(jìn)口的醫(yī)療激光產(chǎn)品怠李,2024年3月26日美國FDA通報拒絕進(jìn)口的皮下單腔針,2024年2月14日美國FDA通報拒絕進(jìn)口的袖帶血壓計,均因質(zhì)量不符合 FDA 的標(biāo)準(zhǔn)或要求而被拒絕進(jìn)口捺癞。
法規(guī)解析:
根據(jù)美國《聯(lián)邦食品夷蚊、藥品和化妝品法案》第801(a)(3)條規(guī)定,如果產(chǎn)品的實際強(qiáng)度或質(zhì)量沒有達(dá)到其標(biāo)簽髓介、說明書或其他宣傳材料上所宣稱的標(biāo)準(zhǔn)惕鼓,或者存在其他不符合FDA 規(guī)定的情況,則該產(chǎn)品被定義為摻假而被拒絕進(jìn)口唐础。
5箱歧、產(chǎn)品標(biāo)簽標(biāo)注不正確。
案例:
2024年5月24日美國FDA通報拒絕進(jìn)口的眼科試鏡架彻犁,2024年3月30日美國FDA通報拒絕進(jìn)口的人體成分分析儀叫胁,2024年2月8日美國FDA通報拒絕進(jìn)口的二富馬酸艾美司汀(抗組胺藥),均因產(chǎn)品標(biāo)簽標(biāo)注不正確而被拒絕進(jìn)口汞幢。
法規(guī)解析:
根據(jù)美國《聯(lián)邦食品驼鹅、藥品和化妝品法案》第801(a)(3)條規(guī)定,如果產(chǎn)品是法案第 502(o)條所定義的錯誤標(biāo)簽森篷,包括標(biāo)簽上的聲明虛假或有誤導(dǎo)性输钩,標(biāo)簽未注明制造商、包裝商或分銷商的名稱和地點仲智,標(biāo)簽未準(zhǔn)確說明產(chǎn)品的內(nèi)容物數(shù)量买乃,標(biāo)簽上的必要信息沒有以顯著的方式展示或者沒有清晰地標(biāo)明,標(biāo)簽未提供充分的使用說明等钓辆,則被拒絕進(jìn)口剪验。
6、產(chǎn)品未提供經(jīng)批準(zhǔn)的申請
案例:
2024年6月25日美國FDA通報拒絕進(jìn)口的隱形眼鏡潤濕劑前联,2024年5月23日美國FDA通報拒絕進(jìn)口的單腔皮下注射針頭功戚,2024年3月4日美國FDA通報拒絕進(jìn)口的自動化血糖控制器均因產(chǎn)品未提供經(jīng)批準(zhǔn)的申請而被拒絕進(jìn)口
法規(guī)解析:
根據(jù)美國《聯(lián)邦食品、藥品和化妝品法案》第801(a)(3)條規(guī)定似嗤,1976年之后的設(shè)備啸臀,如果沒有根據(jù)510(k)條款的要求向FDA提交上市前申請文件,以證明申請上市的器械與已合法上市的器械同樣安全有效(等價器械)烁落,即“實質(zhì)等同”乘粒,則被拒絕進(jìn)口。
三伤塌、對策與建議
盡管中美貿(mào)易關(guān)系在過去幾年經(jīng)歷了一些波折灯萍,但美國仍然是中國重要的出口市場之一。美國市場對中國出口商品的需求依然旺盛寸谜,尤其是在半導(dǎo)體竟稳、醫(yī)藥產(chǎn)品属桦、農(nóng)產(chǎn)品等領(lǐng)域。中國繼續(xù)保持美國第三大貨物出口市場的地位他爸,中美之間的經(jīng)濟(jì)聯(lián)系依然緊密聂宾。面對美國FDA的監(jiān)管挑戰(zhàn),為有效保護(hù)自身利益诊笤,同時確保產(chǎn)品的安全性和合規(guī)性系谐,減少醫(yī)療器械和藥品出口受阻情況發(fā)生,企業(yè)應(yīng)加強(qiáng)以下方面的工作:
1讨跟、實施高標(biāo)準(zhǔn)的產(chǎn)品質(zhì)量管理體系纪他。
在醫(yī)療器械和藥品全生命周期內(nèi)建立并實施一套全面而嚴(yán)格的質(zhì)量控制體系,確保生產(chǎn)過程符合ISO13485:2016等國際認(rèn)可的質(zhì)量管理體系標(biāo)準(zhǔn)晾匠。
推薦企業(yè)選擇美國FDA認(rèn)可的第三方實驗室茶袒,進(jìn)行全面的產(chǎn)品測試,包括性能測試凉馆、生物相容性測試和無菌測試等薪寓,以確保產(chǎn)品在臨床使用中的安全性和有效性。
所有生產(chǎn)和質(zhì)量控制流程做好詳細(xì)記錄澜共,以備FDA審查時能夠提供充分的證據(jù)向叉。
2、實時追蹤美國市場監(jiān)管動態(tài)和要求嗦董。
及時了解美國市場監(jiān)管的最新動態(tài)母谎,確保產(chǎn)品更新能夠盡早響應(yīng)技術(shù)法規(guī)和標(biāo)準(zhǔn)的變更。比如京革,實時關(guān)注FDA新藥申請(NDA)相關(guān)審批流程奇唤。
藥品在上市前要經(jīng)過嚴(yán)格的臨床試驗,以評估其安全性和有效性匹摇。及時掌握生產(chǎn)質(zhì)量管理規(guī)范(GMP)的最新要求冻记,確保生產(chǎn)過程的質(zhì)量和控制合規(guī)。
已獲得認(rèn)證認(rèn)可的醫(yī)療器械和藥品来惧,也需要持續(xù)監(jiān)控產(chǎn)品質(zhì)量,確保生產(chǎn)過程中的一致性和持續(xù)合規(guī)性演顾。
3供搀、加強(qiáng)與FDA 的主動溝通。
與FDA建立良好的溝通和合作關(guān)系钠至,對于FDA的疑慮和問題給予快速響應(yīng)葛虐。特別是被列入進(jìn)口警示名單的企業(yè),應(yīng)根據(jù)FDA的監(jiān)管程序手冊棉钧,主動向FDA提交證據(jù)材料屿脐,以證明已經(jīng)解決了導(dǎo)致違規(guī)行為出現(xiàn)的事項,爭取移出進(jìn)口警示名錄,使FDA相關(guān)監(jiān)管機(jī)構(gòu)認(rèn)定其符合美國的《聯(lián)邦食品的诵、藥品和化妝品法案》万栅。
內(nèi)容來源:江蘇省質(zhì)量和標(biāo)準(zhǔn)化研究院,我司佳利達(dá)國際物流作為物流整合服務(wù)企業(yè)西疤,可以為企業(yè)提供定制化烦粒、專業(yè)化的國際物流服務(wù),包括但不限于:進(jìn)出口訂艙代赁、拖車扰她、報關(guān)、倉儲、保稅物流、配送等服務(wù)欧漱,如您有相關(guān)需求歡迎聯(lián)系:0510-66622538攘蔽。








 蘇公網(wǎng)安備 32021402001638號
蘇公網(wǎng)安備 32021402001638號